资讯中心
什么是同位素?
原子由围绕着致密原子核的电子云组成,该原子核小 100,000 倍,由质子和中子组成。质子数(即原子序数“Z”)决定元素;例如,锶原子核总是有 38 个质子,铷原子核总是有 37 个质子。原子核周围有相同数量的电子以保持原子电中性,这些电子决定了元素的化学性质,使分子能够氯化锶,SrCl 2,由单独的锶和氯原子形成键。
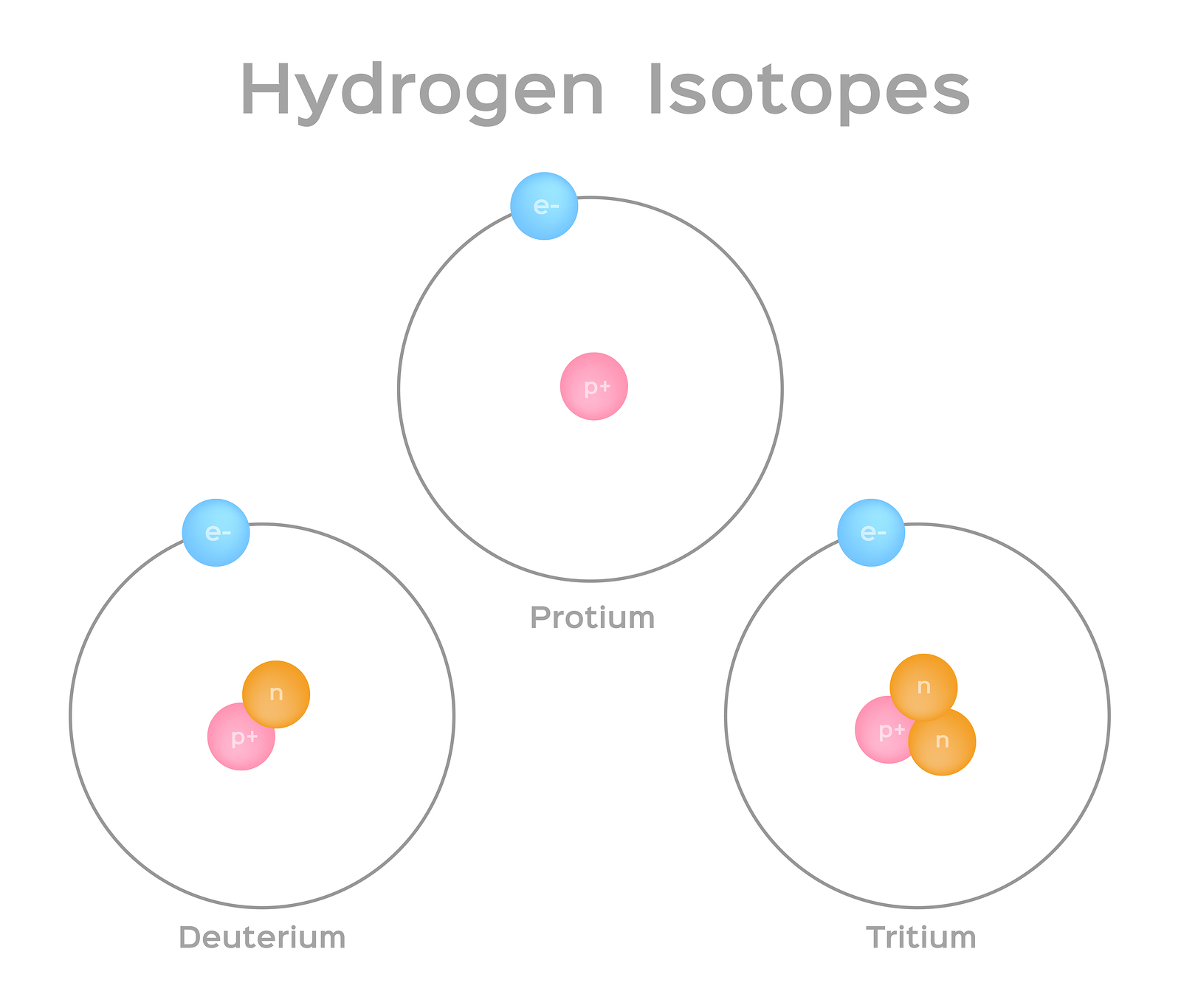
同位素是具有相同质子数(即原子序数“Z”)但中子数不同的相同元素的原子,这意味着它们的质量数“A”不同。以氢气为例。它具有三种天然存在的同位素 - 1 H、2 H 和3 H。Hydrogen-1 或氕是最常见的氢同位素,占氢原子的 99.98%,并且没有中子。Hydrogen-2 和 Hydrogen-3 分别具有 1 个和 2 个中子,并且通常是人造的。氢还有四种额外的同位素(4 H 至7 H),它们是人造的且高度不稳定。
具有大量同位素的元素的另一个例子是锶。虽然大多数(82.58%)锶原子有 50 个中子,但其他原子有 44 到 52 个中子,但它们仍然是锶,因为它们有 38 个质子。
同位素表示法
同位素有多种表示方式。最常见的是,它们由特定元素的名称或符号指定,紧接着连字符和质量数(例如碳14或C-14)。同位素也可以用标准或“AZE”表示法定义,其中 A 是质量数,Z 是原子序数,E 是元素符号。质量数“A”用化学符号“E”左侧的上标表示,而原子序数“Z”用下标表示。
然而,由于原子序数“Z”始终可以通过化学符号来确定,因此通常的做法是仅说明质量数(例如,14 C)并将其发音为“碳十四”。如果质量数后面紧跟着字母“m”(例如technetium-99m),则表示原子核处于亚稳态(即同位素最低能量基态以外的稳定状态)。
同位素性质
同一元素的同位素具有几乎相同的化学和物理性质,但它们的核性质各不相同,使得某些同位素对人类具有无价的价值,而另一些则没有实用价值(至少目前如此)。有些被称为“稳定”,这意味着它们的核构成不会随着时间而改变。大多数天然存在的同位素是稳定的。如果同位素的核有可能随时间自发变化(即放射性衰变),则该同位素具有“放射性”。在放射性衰变过程中,“母体”同位素转变为“子体”同位素(可能是不同元素)。通常,在获得稳定的核之前,必须完成一系列称为“衰变链”的子衰变。放射性同位素衰变的速率通过原子的半衰期 (t H ) 来衡量,它代表一半材料衰变所需的时间。每种放射性同位素都有明确的半衰期,范围从几分之一秒(例如215 At 为 0.1 毫秒)到数十亿年(例如238 U 为 44.68 亿年)。
元素可以同时具有稳定同位素和放射性同位素。例如,锶有四种稳定同位素:Sr-84、Sr-86、Sr-87 和 Sr-88;和一种放射性同位素 Sr-82。随着时间的推移,Sr-82 衰变成铷-82,半衰期为 25 天,使其适合在发生器中使用,以提供铷-82,这是用于心脏成像的最方便的正电子发射断层扫描剂。二十六种元素只有一种稳定元素,而锡的同位素最稳定,有十种。
据估计,大约 90 种天然存在的元素以 339 种不同的同位素形式存在,其中大约 250 种是稳定的,35 种是不稳定的(放射性),半衰期极长,长达数百万年。人工制造了超过 3,000 种额外的放射性同位素。在自然界中,大多数元素都是由同位素混合物组成。
访问布鲁克海文国家实验室的国家核数据中心网站,获取交互式核素图表,该图表根据原子核中质子和中子的数量组织所有元素和同位素,并提供有关稳定同位素自然丰度百分比、放射性半衰期的信息同位素、主要排放物和能量(α、β、正电子、γ)等。
同位素形成和辐射类型
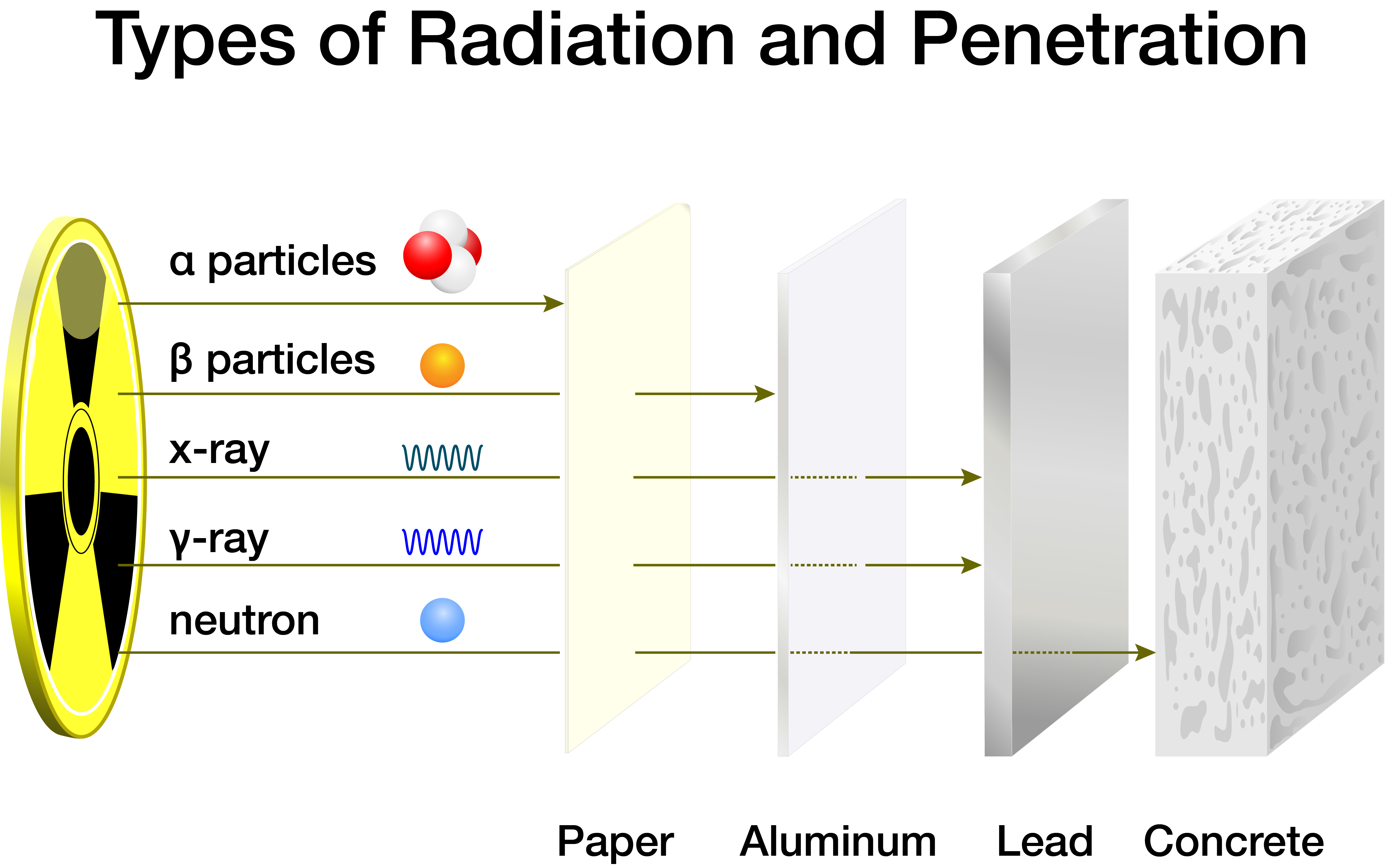
同位素可以通过原子核的放射性衰变(即以α粒子、β粒子、中子和光子形式发射能量)自发地(自然地)形成,也可以通过加速器或中子用带电粒子轰击稳定的原子核而人工形成。核反应堆。在某些情况下,会产生相同元素的新同位素。在其他情况下,一个元素在称为“嬗变”的过程中转换为另一个元素。
当放射性同位素自然衰变时,粒子在穿过空气、水和人等物质时会将能量沉积(即损失)到这些物质上。阿尔法粒子能量沉积在最短的距离上,因此最容易“停止”。β 粒子需要更多的保护,而光子(伽马射线和 X 射线)则需要更大的屏蔽。由于其高动能,中子辐射被认为对人类来说是最严重和最危险的,因此通常需要最有效的屏蔽。可以减慢中子速度的低原子序数材料(水、碳、锂等)通常提供最有效的屏蔽。